|
Тренировочные задания
1.1.
Классификация белков по составу
  Рассмотрите
белок Pdb1cyo.ent. Как Вы считаете, это
простой белок или сложный? Если сложный - к какому типу сложных белков
принадлежит? Рассмотрите
белок Pdb1cyo.ent. Как Вы считаете, это
простой белок или сложный? Если сложный - к какому типу сложных белков
принадлежит?
Комментарий.
При работе с белком
оптимальной есть такая последовательность работы: отобразить вторичную и
третичную структуры молекулы (пункты главного меню
программы Display
- Ribbons
и Colours
- Structure),
выделить небелковые компоненты молекулы (команда
select
hetero,
введенная
в
командном окне) и изменить способ отображения выделенных атомов (например,
Display
-
Spacefill
и
Colours
- CPK).
После этого нужно убрать молекулы воды,
которые
обязательно находятся вокруг молекулы; для этого нужно их выделить и избрать
такой способ отображения, который не показывает
ее (например, Display
- Wireframe
или Backbone).
Если остались какие-то небелковые элементы молекулы, белок считаем
сложным. Помните, что при необходимости можно воспользоваться
Памяткой по работе с программой RasMol
и Памяткой по использованию командного окна команды
RasMol.
1.2. Классификация белков по структуре: глобулярные,
фибриллярные и мембранные
  Рассмотрите
белки 1a7w.pdb и
pdb1cek.ent. Какой из этих белков
мембранный, а какой - глобулярный? Проиллюстрируйте ответ рисунками. Рассмотрите
белки 1a7w.pdb и
pdb1cek.ent. Какой из этих белков
мембранный, а какой - глобулярный? Проиллюстрируйте ответ рисунками.
Комментарий.
Подумайте, какие
группы аминокислот лучше выделить для ответа на вопрос. Для создания рисунков
используйте пункт главного меню программы
Export -
GIF или
BMP, в
диалоговом окне укажите название файла (желательно такое, чтобы можно было
понять, к какой задаче рисунок), и укажите путь к созданной вами папки. После
сохранения файла изображение можно отредактировать в графическом редакторе
Paint, например, сделать обозначение к рисунку. Если Отчет оформляется в
текстовом файле MS Word, изображение можно вставить непосредственно к тексту
Отчета.
1.3. Классификация белков по функциям: ферменты
 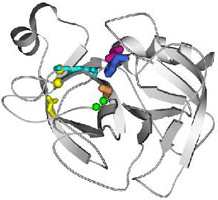  Рассмотрите
рис. справа, изображающий
фермент трипсин с аминокислотами, которые входят в активный центр белка (маленький
рисунок является ссылкам на увеличенное изображение).
Рассмотрите
рис. справа, изображающий
фермент трипсин с аминокислотами, которые входят в активный центр белка (маленький
рисунок является ссылкам на увеличенное изображение).
Положение активного центра в серинових
протеазах; показан состав активного центра:
каталитический центр, в котором выделены
боковые группы "триады переноса заряда" —
Ser195 (оранжевый), His57 (синий) и
Asp102 (малиновый), и субстрат-связывающий
центр, в котором зеленым изображено
NH-группы, которые образовывают оксианионную
дыру, голубым — неспецифичная
субстрат-связывающая площадка, и желтым -
группы, которые выстилают специфический
субстрат-связывающий карман. Рассмотрите
механизм
ферментативного гидролиза пептида.
 Откройте
файл pdb1aq7.ent.
Создайте рисунок, подобный приведенному справа,
и сохраните его в собственную папку. Откройте
файл pdb1aq7.ent.
Создайте рисунок, подобный приведенному справа,
и сохраните его в собственную папку.
4.
Расчетное задание
Шаг α-спирали белка составляет 5,4 Å, на один виток спирали приходиться
3,6 аминокислотных остатка. Линейная длина аминокислотного остатка в первичной
структуре белка
(расстояние между Сαn і Зαn+1)
равняется 3,5
Å. Найдите диаметр углерод-азотного остова α-спирали.
(См.
справочный файл)
 Комментарий.
Можно проиллюстрировать соответствующим рисунком, на
котором проставить, как на чертеже, размеры. Воспользуйтесь для этого файлом pdb1gf2.ent
(инсулиноподобный гормон). Для выполнения задания достаточно возможностей
графического редактора Paint. Комментарий.
Можно проиллюстрировать соответствующим рисунком, на
котором проставить, как на чертеже, размеры. Воспользуйтесь для этого файлом pdb1gf2.ent
(инсулиноподобный гормон). Для выполнения задания достаточно возможностей
графического редактора Paint.

См. моделирование альфа-спирали из
бумаги.
Задания для итоговой работы
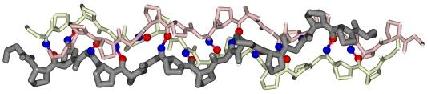 1. Коллаген 1. Коллаген
 Откройте
файл
pdb1a89.ent.
Изучаем особый вариант
вторичной структуры белка - коллагеновую тройную
суперспираль. Откройте
файл
pdb1a89.ent.
Изучаем особый вариант
вторичной структуры белка - коллагеновую тройную
суперспираль.
 Рассмотрите
очень внимательно структуру коллагена - одного
из важнейших белков соединительной ткани. Чем
отличается строение его вторичной структуры от
обычной α-спирали (для сравнения можно открыть
файл
pdb1gf2.ent
с
типичной α-спиралью)?
Каких аминокислот больше всего в молекуле
коллагена и как это связано с его структурой?
Какими связями соединяются между собой отдельные
цепи в суперспираль? Рассмотрите
очень внимательно структуру коллагена - одного
из важнейших белков соединительной ткани. Чем
отличается строение его вторичной структуры от
обычной α-спирали (для сравнения можно открыть
файл
pdb1gf2.ent
с
типичной α-спиралью)?
Каких аминокислот больше всего в молекуле
коллагена и как это связано с его структурой?
Какими связями соединяются между собой отдельные
цепи в суперспираль?
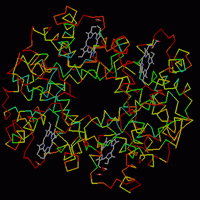 2.
Мутантные гемоглобины. 2.
Мутантные гемоглобины.

Откройте файл
pdb1bij.ent.
Изучаем разные
гемоглобинопатии - заболевания, вызванные
дефектным синтезом гемоглобина.

Известно
много типов гемоглобинопатий - заболеваний,
связанных с изменениями в молекуле гемоглобина.
Назовем природу некоторых из них:
а)
Серповидно-клеточная анемия. В β-цепях
молекулы в 6-му положении вместо глютаминовой
кислоты аминокислота валин.
б) Гемоглобин "
Гайд-Парк". В β-цепях молекулы в 92-м
положении вместо гистидина аминокислота тирозин.
в) Е-Гемоглобинопатия.
В β-цепях молекулы в 26-м положении вместо
глютаминовой кислоты аминокислота лизин.
г) Гемоглобин "Цюрих".
В β-цепях молекулы в 63-м положении вместо
гистидина аминокислота аргинин.
Объясните, почему в каждом из случаев
развивается заболевание, и как связаны
молекулярные замены аминокислот с изменениями на
уровне клеток и организма в целом.
Комментарий.
При выделении изберите оптимальный способ
отображения молекулы,
выделите гемы, а лишь после этого переходите к
поиску аминокислот, которые удобнее окрашивать в
свой цвет каждую (Colours
- Shapely).
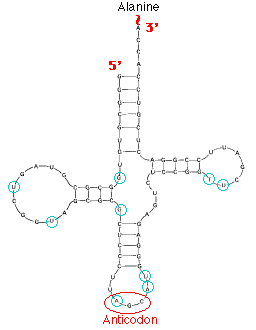 3.
тРНК дрожжей 3.
тРНК дрожжей
 Откройте
файл pdb5tra.ent. Вы работаете с
молекулой транспортной РНК дрожжей. Откройте
файл pdb5tra.ent. Вы работаете с
молекулой транспортной РНК дрожжей.
 1. На рис.
справа сторону изображена вторичная структура тРНК. Как выглядит третичная структура этой
молекулы? (Можно проиллюстрировать рисунком).
1. На рис.
справа сторону изображена вторичная структура тРНК. Как выглядит третичная структура этой
молекулы? (Можно проиллюстрировать рисунком).
 2. К какому
по номеру нуклеотиду присоединяется
аминокислота, которую тРНК переносит?
2. К какому
по номеру нуклеотиду присоединяется
аминокислота, которую тРНК переносит?
 3. Антикодон
тРНК дрожжей - это 34, 35 и 36-и нуклеотиды.
Выясните, какую аминокислоту переносит этот тип
тРНК.
3. Антикодон
тРНК дрожжей - это 34, 35 и 36-и нуклеотиды.
Выясните, какую аминокислоту переносит этот тип
тРНК.
Комментарий.
1. Это не
обязательно аланиновая тРНК, как на рисунке.
2. Для работы
понадобится
таблица генетического кода.
В ответ включите
названия соответствующих нуклеотидов,
входящих в антикодон.
3. Помните, что в состав РНК могут входить
нетипичные нуклеотиды.
4. Можно проверить ответ, открыв файл
pdb5tra.ent
как текстовый. В таком случае
процитируйте в Отчете сведения из файла.
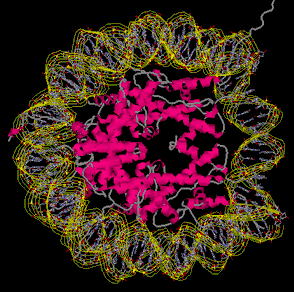 4. Нуклеосома 4. Нуклеосома
 Откройте
файл
pdb1aoi.ent.
Изучаем особенности
строения гистонов, входящих в состав нуклеосомы. Откройте
файл
pdb1aoi.ent.
Изучаем особенности
строения гистонов, входящих в состав нуклеосомы.
 1. Принято
считать, что подавляющее большинство аминокислот
белков-гистонов составляют щелочные аминокислоты
(лизин, аргинин, гистидин). Проверьте, открыв
файл как текстовый, отвечает ли это реальности.
Запишите в Отчет (или проиллюстрируйте
диаграммой) результаты расчетов.
1. Принято
считать, что подавляющее большинство аминокислот
белков-гистонов составляют щелочные аминокислоты
(лизин, аргинин, гистидин). Проверьте, открыв
файл как текстовый, отвечает ли это реальности.
Запишите в Отчет (или проиллюстрируйте
диаграммой) результаты расчетов.
 2. Как
расположены в молекулах гистонов остатки
щелочных аминокислот? Проиллюстрируйте ответ
рисунком.
2. Как
расположены в молекулах гистонов остатки
щелочных аминокислот? Проиллюстрируйте ответ
рисунком.
 3.
Почему в S-периоде интерфазы остатки этих
аминокислот подвергаются химической модификации?
3.
Почему в S-периоде интерфазы остатки этих
аминокислот подвергаются химической модификации? |